Lösungen
Elektrochemie
14.2 Elektrochemie
Als Daten brachen Sie die
Redoxpotentiale, die bei jedem Element im PSE angegeben sind.
In einer bestimmten galvanischen Zelle kommen diese vier
Stoffe vor:
Cr, Cu, Cu+, Cr2+
a) Welches
ist das stärkste Reduktionsmittel unter ihnen?
Cr
(mit 0.91 V von Oxidationsstufe O nach II hat es das höchste Potential in der
Reduktion
gegenüber Cu
mit -0.52 V, Cu+ und Cr2+ sind
Oxidationsmittel)
b) Welche beiden Stoffe müssen die Edukte
sein, damit diese galvanische Zelle elektrischen Strom abgibt?
Cr und Cu+
(wenn Chrom oxidiert, muss Kupfer reduzieren)
c) Formulieren Sie die vollständige
Reaktionsgleichung der Redoxreaktion dieser galvanischen Zelle.
Cr + 2 Cu+ ![]() Cr2+ + 2 Cu
Cr2+ + 2 Cu
d) Welches Potential hat diese
Redoxreaktion?
+0.52 V + (-(-0.91 V)) = +1.43 V
e) Lässt sich Magnesium einfacher
oxidieren oder reduzieren?
einfacher oxidieren
(die Oxidationsreaktion hat ein Potential
von +2,37 V,
die Reduktionsreaktion hätte -2,37 V)
f) Wirkt Magnesium eher oxidierend oder
reduzierend?
Auf andere Stoffe wirkt Magnesium stark
reduzierend.
(Während sich Magnesium oxidieren lässt,
gibt es Elektronen
auf andere Stoffe ab und reduziert sie.)
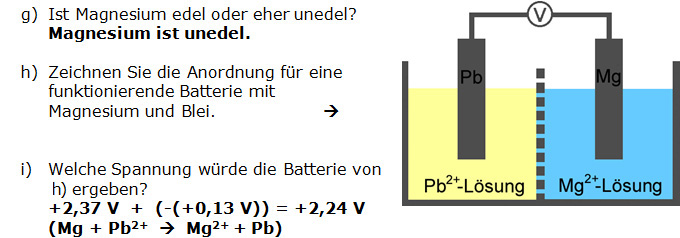
j) Wie erreicht man mit Magnesium und Blei eine
Spannung, die doppelt
so gross ist
wie diejenige von i)?
Zwei Magnesium-Blei-Batterien hintereinander schalten.